2021年7月2日,威廉希尔体育刘彬教授团队和中国科学院上海药物研究所谭敏佳研究员团队共同在 Cell Death & Differentiation(2020影响因子15.8分)杂志上在线发表了题为“Global identification of phospho-dependent SCF substrates reveals a FBXO22 phosphodegron and an ERK-FBXO22-BAG3 axis in tumorigenesis”的研究成果。
SKP1-CUL1-F-box(SCF)泛素E3连接酶复合物介导的蛋白泛素化降解参与了细胞周期运转,DNA损伤修饰,肿瘤发生发展等各种重大的生理病理过程。通常而言,底物蛋白的降解结构域“phosphodegron”被蛋白激酶磷酸化是SCF识别和泛素化降解所必需。尽管系统性鉴定SCF的泛素化底物的方法已有报道,然而,系统全面精准定位SCF泛素E3连接酶底物的“phosphodegron”,一直阻碍了整个领域的进展。
本研究利用定量蛋白质组学和磷酸化组学的方法,通过独辟蹊径的磷酸化底物筛选新策略,全景式鉴定了SCF泛素E3连接酶底物的磷酸化位点,发现了全新的受SCFFBXO22识别的“phosphodegron”,全面揭示了蛋白磷酸化修饰在 SCF 复合体介导的底物蛋白泛素化降解过程中的普遍性和特异性,为深入研究磷酸化修饰和泛素化修饰的“cross-talk”提供了崭新的思路。
本研究还通过多种分子生物学和蛋白质组学策略,首次揭示了SCFFBXO22为BAG3的泛素E3连接酶,FBXO22通过识别ERK催化的BAG3 的S377位点的磷酸化位点来促进BAG3的泛素化降解。本研究同时也验证了FBXO22识别底物上的“phosphodegron”的普遍性,探索了ERK-FBXO22-BAG3调控轴在肿瘤发展发展中的分子生物学机制,为肿瘤的发生发展机制研究提供了新策略。
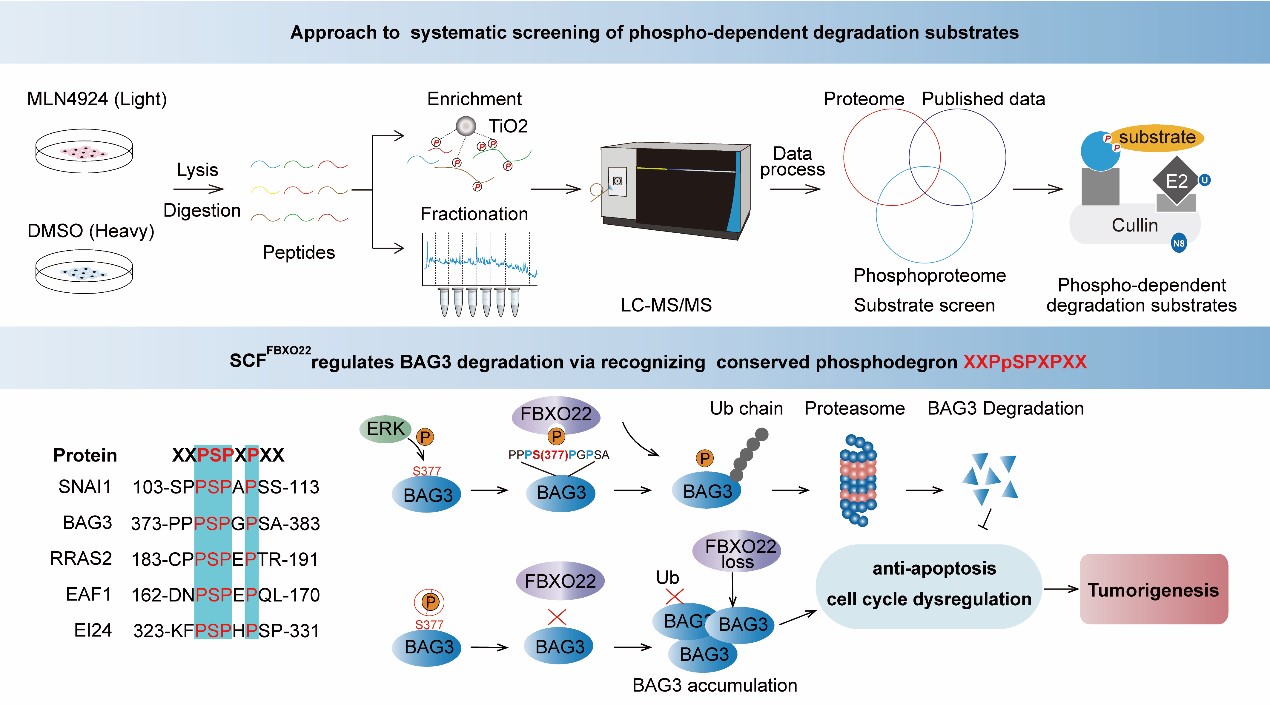
图1. 系统性筛选磷酸化依赖的泛素降解底物研究
该研究获得了国家自然科学基金、国家重点研发计划、国家科技重大专项、江苏特聘教授以及中国科学院先导专项等的资助。
文章链接:https://www.nature.com/articles/s41418-021-00827-7